- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:33.
- Zadnja izmjena 2025-06-01 07:36.
Ključna razlika između dušikovog monoksida i dinitrogen pentoksida je u tome što je dušikov monoksid bezbojni plin dok je dizot-monoksid bijela čvrsta supstanca.
Azot monoksid i dinitrogen pentoksid su hemijska jedinjenja koja sadrže azot i kiseonik. To su dušikovi oksidi. Međutim, oni imaju različita hemijska i fizička svojstva.
Šta je dušikov monoksid?
Azot monoksid je neorgansko jedinjenje koje ima hemijsku formulu NO. Zovemo ga dušikov oksid jer je dušikov oksid. To je zapravo slobodni radikal jer ima nespareni elektron. Štaviše, to je heteronuklearni dvoatomski molekul.
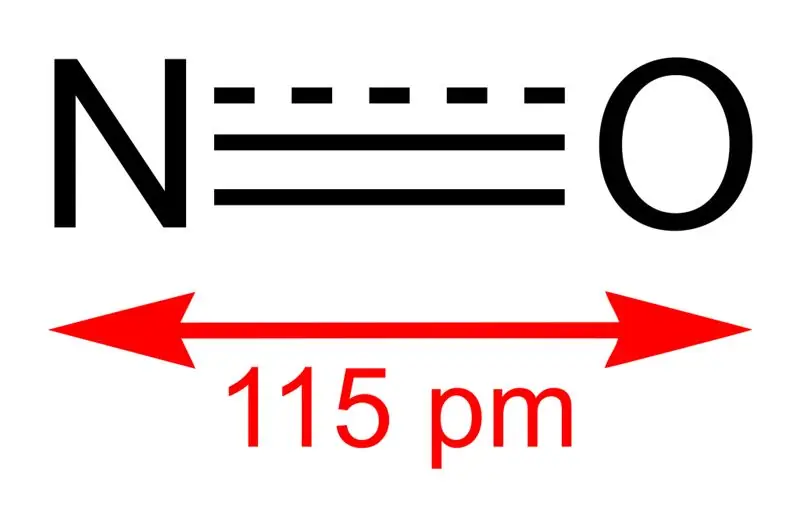
Slika 01: Struktura dušikovog monoksida i dužina veze između N i O
Molarna masa ovog jedinjenja je 30 g/mol. Javlja se kao bezbojni gas. Osim toga, njegova tačka topljenja je -164 °C, dok je tačka ključanja -152 °C, što su vrlo male vrijednosti u poređenju s onima drugih dušikovih oksida. Ovaj slobodni radikal možemo proizvesti oksidacijom amonijaka na 850 °C u prisustvu platinastog katalizatora. Međutim, u laboratorijskoj skali, možemo ga pripremiti redukcijom razrijeđene dušične kiseline bakrom.
Šta je dinitrogen pentoksid?
Dizot pentoksid je neorgansko jedinjenje koje ima hemijsku formulu N2O5 Mi ga zovemo azot pentoksid. To je binarni dušikov oksid. Osim toga, nestabilan je i može djelovati kao opasan oksidant. Molarna masa jedinjenja je 108,01 g/mol. Pojavljuje se čvrsta bijela boja.
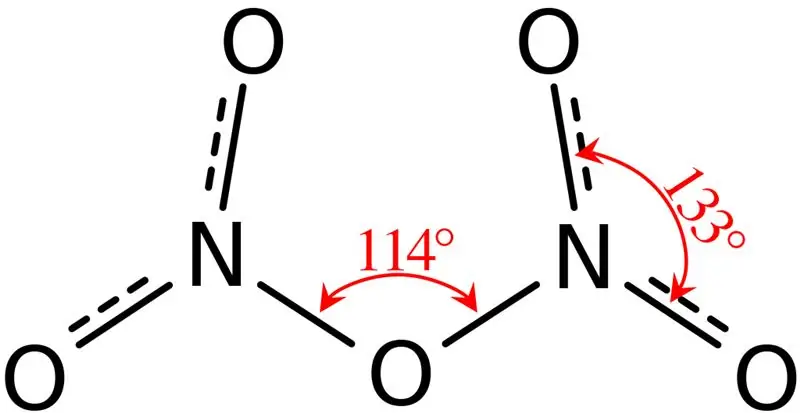
Slika 02: Struktura dinitrogen pentoksida
Dalje, tačka topljenja ovog jedinjenja je 41 °C, a na 47 °C ovo jedinjenje prolazi kroz sublimaciju. Ovo jedinjenje reaguje sa vodom dajući dušičnu kiselinu. Osim toga, molekularni oblik molekule dinitrogen pentoksida je ravan. Možemo proizvesti ovo jedinjenje dehidracijom dušične kiseline sa fosfornim pentoksidom.
Koja je razlika između dušikovog monoksida i dinitrogen pentoksida?
Azot monoksid je neorgansko jedinjenje koje ima hemijsku formulu NO, dok je dinitrogen pentoksid neorgansko jedinjenje koje ima hemijsku formulu N2O5 Ključna razlika između dušikovog monoksida i dinitrogen pentoksida je u tome što je dušikov monoksid bezbojni plin, dok je dinitrogen pentoksid bijela čvrsta supstanca. Štaviše, dušikov monoksid možemo proizvesti oksidacijom amonijaka na 850 °C u prisustvu platinskog katalizatora. Međutim, proizvodnja dinitrogen pentoksida odvija se dehidratacijom dušične kiseline fosfornim pentoksidom. Kada se uzme u obzir molekularni oblik, dušikov monoksid je linearan dok je azot pentoksid ravan.
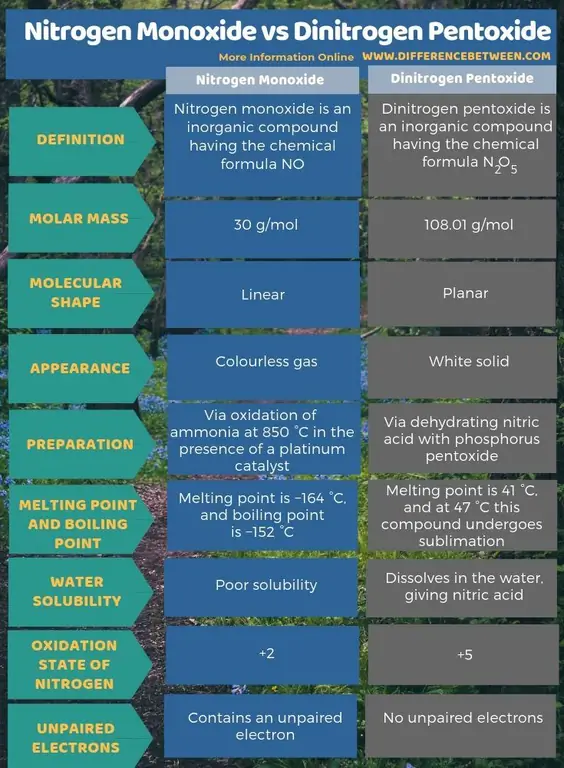
Sažetak - dušikov monoksid vs dinitrogen pentoksid
Azot monoksid je neorgansko jedinjenje koje ima hemijsku formulu NO, dok je dinitrogen pentoksid neorgansko jedinjenje koje ima hemijsku formulu N2O5 Ključna razlika između dušikovog monoksida i azotnog pentoksida je u tome što je dušikov monoksid bezbojni plin, dok je dinitrogen pentoksid bijela čvrsta supstanca.






