- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:33.
- Zadnja izmjena 2025-06-01 07:36.
Ključna razlika između ugljene kiseline i bikarbonata je u tome što je ugljena kiselina neutralno hemijsko jedinjenje, dok je bikarbonat negativno naelektrisan hemijski spoj.
Ugljena kiselina je slaba kiselina koja nastaje u rastvoru kada se ugljen-dioksid rastvori u vodi, sa hemijskom formulom H2CO3. Bikarbonat nastaje kombinacijom tri atoma kiseonika, atoma vodika i atoma ugljika sa hemijskom formulom HCO3-.
Šta je ugljična kiselina?
Ugljena kiselina je H2CO3. Ponekad ovo ime dajemo otopinama koje imaju ugljični dioksid otopljen u vodi ili gaziranoj vodi. To je zato što gazirana voda sadrži malu količinu H2CO3. Nadalje, ugljična kiselina je slaba kiselina i može formirati dvije vrste soli kao što su karbonati i bikarbonati. Molarna masa ovog jedinjenja je 62,024 g/mol.
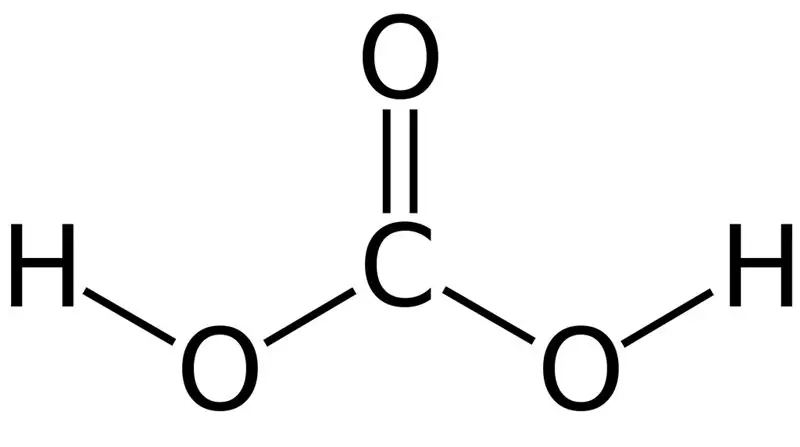
Slika 01: Hemijska struktura ugljične kiseline
Kada se ugljični dioksid otopi u vodi, on ulazi u ravnotežu između ugljičnog dioksida i ugljične kiseline. Ravnoteža je sljedeća:
CO2 + H2O ⟷ H2CO3
Ako u bazu dodamo višak ugljene kiseline, dobija se bikarbonat. Ali, ako postoji višak baze, onda ugljena kiselina ima tendenciju da daje gazirane soli. Preciznije, karbonska kiselina je spoj karboksilne kiseline koji ima dva supstituenta hidroksilne grupe vezana za karbonil ugljik. Štaviše, to je poliprotična kiselina, koja je sposobna donirati protone. Ima dva protona koja se mogu ukloniti, tako da je specifično diprotičan.
Šta je bikarbonat?
Bikarbonat nastaje kombinacijom tri atoma kiseonika, atoma vodika i atoma ugljenika. Proizvod ove kombinacije može biti ion ili jedinjenje s više elektrona nego protona. Možemo ga opisati kao hemijsku vrstu koja ima hemijsku formulu HCO3-.
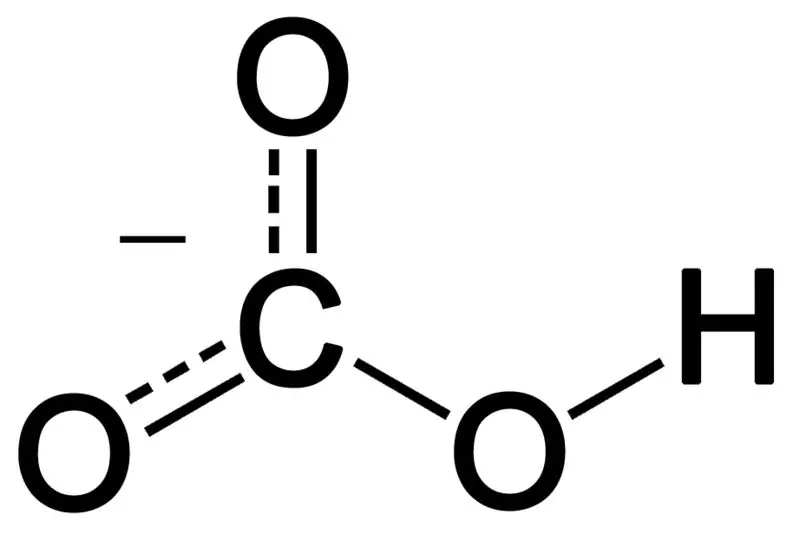
Slika 02: Hemijska struktura bikarbonatnog aniona
Ovo jedinjenje je ključni dio tjelesnog pH puferskog sistema, laički rečeno: odgovorno je za održavanje nečije krvi u stanju koje nije previše kiselo ili previše bazično. Osim toga, služi kao način za držanje probavnih sokova pod kontrolom nakon što želudac završi sa varenjem hrane. Nadalje, ugljena kiselina u kišnici stvara bikarbonatne ione kada udari u stijene. Ovaj protok bikarbonatnih jona je važan za održavanje ciklusa ugljika.
Koja je razlika između ugljične kiseline i bikarbonata?
Ugljena kiselina je slaba kiselina koja nastaje u rastvoru kada se ugljen-dioksid otapa u vodi, a njena hemijska formula je H2CO3. Bikarbonat nastaje kombinacijom tri atoma kisika, atoma vodika i atoma ugljika s kemijskom formulom HCO3-. Ključna razlika između ugljene kiseline i bikarbonata je u tome što je ugljena kiselina neutralno hemijsko jedinjenje, dok je bikarbonat negativno naelektrisan hemijski spoj. Štaviše, ugljena kiselina se koristi u pravljenju mehurastih, gaziranih napitaka, liječenju dermatitisa, u vodi za ispiranje usta itd., dok se bikarbonat koristi u pripremama hrane kao što je pečenje (kao sredstvo za dizanje), a daje sposobnost otpornosti na promjene pH vrijednosti.
Sljedeća infografika sažima razliku između ugljične kiseline i bikarbonata u obliku tabele za usporedbu.
Sažetak - ugljična kiselina vs bikarbonat
Ugljena kiselina je H2CO3. Bikarbonat nastaje kombinacijom tri atoma kiseonika, atoma vodika i atoma ugljika, sa hemijskom formulom HCO3-. Ključna razlika između ugljene kiseline i bikarbonata je u tome što je ugljena kiselina neutralno hemijsko jedinjenje, dok je bikarbonat negativno naelektrisan hemijski spoj.






